
Personaliserte Medizin in Österreich anhand von Genom-Analysen: Potentiale und Entwicklungen.
Medikamentöse Therapien, zugeschnitten auf die individuelle physiologische Konstitution von PatientInnen – schon vor Jahren entstand daraus ein anhaltender Trend in der Medizin.
Heute wird intensiv an der Entwicklung kostengünstiger und zuverlässiger diagnostischer Verfahren geforscht und besonders in der Onkologie sind personalisierte Therapieansätze bereits Realität.
Wir wollen wissen, was die Biomarkerdiagnostik derzeit kann, wo ihre Potentiale liegen und an welche Grenzen man gestoßen ist.
Genanalysen als Grundlage prädiktiver Diagnostik
Dem österreichischen Gentechnikgesetz (GTG) zufolge darf eine DNA-Analyse in zwei Fällen eingesetzt werden: Bei einer Erkrankung, die bereits besteht, oder bei einer, bei der (noch) keine Symptome vorhanden sind.
Letzteres Einsatzgebiet gehört zu den umstrittensten, besonders, wenn es sich um Voraussagen zu einer erbbedingten Erkrankung handelt, bei der weder eine Prophylaxe noch eine Therapie möglich sind.
Die Bedeutung prädiktiver Diagnoseverfahren wird laut Österreichischer Akademie der Wissenschaften in den nächsten Jahren weiter wachsen - allerdings steht man der Aussagekraft von DNA-Tests und ihrem tatsächlichen Nutzen hinsichtlich einer Heilung kritisch gegenüber, denn diese sind stark abhängig von
- der Anzahl der Gene, die bei der Entstehung einer Krankheit beteiligt sind und
- der Expressivität einer Krankheit, also wie hoch das Risiko eines Krankheitsausbruches ist.
Grundsätzlich gilt: Sind bei einer Krankheit mehr als 10 verschiedene Genmutationen vorhanden, sinkt die Aussagekraft von DNA-Analysen bereits erheblich.
Relativ zuverlässig: Aussagen zu monogen erblichen Krankheiten
Am zuverlässigsten sind Gentest-Ergebnisse daher bei monogen vererbten Krankheiten, die mit hoher Penetranz, also hoher Manifestationswahrscheinlichkeit eines Genotyps, zur Entstehung eines bestimmten Phänotyps führen. Monogen vererbte Krankheiten sind allerdings selten - und nicht immer kommt es auch zur einem Ausbruch der Erkrankung.
Wird im Rahmen eines Gentests eine Hämochromatose diagnostiziert, so bedeutet dies nur in ca. 1-2 % der Fälle tatsächlich einen Krankheitsausbruch bei den Betroffenen.
Prädiktive Diagnostik in der Onkologie
Burstkrebs, Kolorektalkarzinome und Leukämien: Bisher wurden etwa 400 Krebsgene identifiziert, die zur Entstehung der Erkrankung beitragen. Eine DNA-Analyse kann als Basis für die Zusammenstellung geeigneter Therapiemaßnahmen, die mit erhöhter Wahrscheinlichkeit wirken werden, dienen.
Beispiele für Krebsarten, deren Entstehung stark durch vererbbare genetische Veränderungen bedingt sind, sind Brust- und Eierstockkrebs mit einer BRCA-Mutation: Die Wahrscheinlichkeit einer Brustkrebserkrankung liegt bei BRCA1-Trägern im Schnitt bei 65 Prozent, auch das Risiko an Eierstockkrebs zu erkranken ist mit etwa 50 Prozent vor dem 70.Lebensjahr hoch.
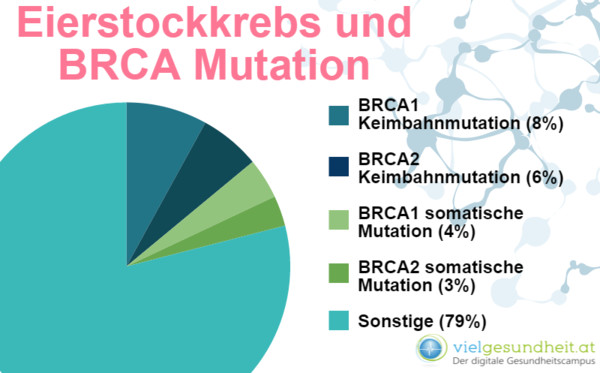
In Österreich werden genetische Tests beim Mammakarzinom überwiegend zentral an der Univ.-Frauenklinik Wien durchgeführt, während Beratungen in den regionalen Beratungsstellen erfolgen. Laut ÖAW zeichnet sich in den deutschsprachigen Ländern sowie in den Niederlanden ein Trend in Richtung genetischer Beratung in Form interdisziplinärer Teams an speziellen Zentren ab.
Prophylaktische chirurgische Interventionen wie etwa eine prophylaktische Masektomie können zwar das Risiko einer Erkrankung erheblich senken, sie werden jedoch in Österreich und Deutschland aufgrund niedrigerer kultureller Akzeptanz wenig in Anspruch genommen.
Wie aussagekräftig ist die prädiktive Diagnostik?
Die Möglichkeiten und die Genauigkeit genetischer Tests werden besonders in der Onkologie oft überschätzt:
Beim Ovarialkarzinom sind nur etwa 20 Prozent der Erkrankungen auf veränderte Erbanlagen zurückzuführen; Schätzungen zufolge entstehen nur etwa 5-10% der Krebserkrankungen durch vererbte genetische Mutationen.
Bei der Interpretation von Testergebnissen kommt es immer wieder zu unterschiedlichen objektiven Ergebnissen, die zum Beispiel durch kleinste technische Probleme, etwa Kopierfehler bei Klonierungsschritten, entstehen können. In einer Stellungnahme des deutschen Ethikrats von 2013 heißt es dazu:
Die Wiederholung von Tests oder die Validierung ihrer Ergebnisse mithilfe anderer Methoden kann helfen, Fehlinterpretationen aufgrund technisch bedingter falscher Diagnosen vorzubeugen. Dies ist allerdings mit hohem Kostenaufwand verbunden. (S.52)
Molekularbiologische Untersuchungen an Tumoren
Liegt bereits eine Krebserkrankung vor, werden Gentests bei der Untersuchung mutierten Tumorgewebes eingesetzt.
Die laufende EXACT- Pilotstudie der MedUni Wien zielt auf lange Sicht auf die Etablierung einer individuellen Krebsmedizin in Österreich ab. Dabei werden 55 Patienten mit fortgeschrittener Krebserkrankung, die eine kurative Behandlung ausschließt, einer Targeted Therapy unterzogen:
Gewebeproben werden aus den Tumoren entnommen und die Erbsubstanz der Tumorzellen entschlüsselt. Insgesamt wird auf 45 Onkogene und 749 mögliche Mutationen getestet, ausgewertet und als Grundlage für eine zielgerichtete Behandlung hergenommen.
Eine offene Frage für den Kliniker ist, wie man seltene Mutationen in noch selteneren Tumoren adressiert, für die keine Standardtherapien existieren, und wie man Patienten damit nachweislich helfen kann.
Pathologen, Bioinformatiker, Onkologen und Melokularbiologen arbeiten gemeinsam auf der Suche nach passenden Therapieansätzen. Die aus der Studie gewonnenen Daten dienen der Schaffung eines komplexen Systems, das in Zukunft mithilfe eines Algorithmus DNA-Daten mit zielgerichteten Medikamenten verbinden soll:
Weg von sogenannten Blockbuster-Therapien hin zu fein auf den jeweiligen Krebs abgestimmten Behandlungsansätzen.
Dazu müssen jedoch eine Menge Daten gesammelt werden- denn Krebs ist nicht gleich Krebs – laut Onkologe Univ. Prof. Dr. Prager und Univ. Prof. Dr. Zielsinki, Leiter der Klinischen Abteilung für Onkologie, wird zukünftig die Einteilung der Krebserkrankungen nicht nach Organen, sondern genetischen Veränderungen erfolgen.
Je mehr Daten gesammelt und in das System eingespeist werden, desto wahrscheinlicher ist die Einführung einer Kosten- und Zeitsparenden Therapie in der Zukunft.
Ziel der Studie ist, so Zielinski, zu zeigen, dass mindestens bei 55 Prozent der PatientInnen das Fortschreiten der Erkrankung um die Zeitspanne der Vortherapie verlängert werden kann.
Erste Berichte zu den Ergebnissen sind vielversprechend.






