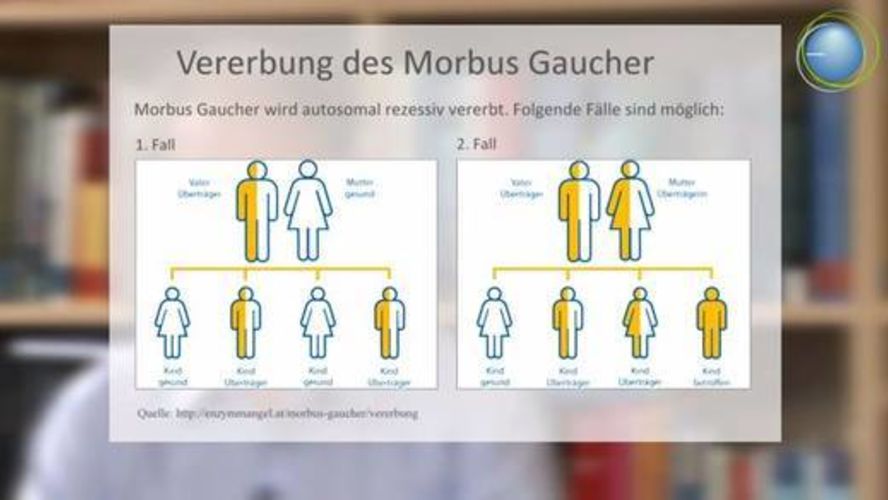
Zu der Gruppe der lysosomalen Speichererkrankungen gehört auch der Morbus Gaucher – eine seltene Erkrankung.
Wie die meisten Stoffwechselerkrankungen ist hier die Ursache ein genetischer Defekt, der zu einer geringen Enzymaktivität führt. Lange Zeit gab es keine Therapiemöglichkeiten: seit nun mehr zehn Jahren steht aber die Enzymersatztherapie zu Verfügung.
Bis es zur Therapie kommt, vergehen oft viele Jahre. Aufgrund des seltenen Vorkommens von Erkrankungen wie Morbus Gaucher ist das Niveau der Ausbildungs- und Wissensqualifikation hinsichtlich seltener Erkrankungen nur wenig ausgeprägt - die Expertise ist rar.
Unterschiedliche Umstände führen letztlich dazu, dass die Erkrankung entdeckt wird.
In diesem Beitrag besprechen Experten für Seltenen Stoffwechselerkrankungen, welche Symptome auf einen Morbus Gaucher hinweisen könnten und welche Hilfestellungen bei einer schwierigen Diagnostik zu finden sind.
Experten:
- Univ. Prof. Dr. Daniela Karall
Medizinische Universität Innsbruck - Univ.-Prof. DDr. Johannes Zschocke
Medizinische Universität Innsbruck - Ao. Univ. Prof. Dr. Thomas Stulnig
Medizinische Universität Wien / AKH Wien - Dr. Vassiliki Konstantopoulou
Wr. Kinderklinik, AKH Wien - Univ. Prof.in Dr.in Susanne Greber-Platzer
Wr. Kinderklinik, AKH Wien - Doz. Dr. med. Kaan Boztug
Center for Molecular Medicine, Wien - Ass.Prof.Priv.Doz. Dr. Till Voigtländer
Klinisches Instut für Neurologie, Medizinische Universität, Koordinator für Orphanet Österreich - Dr. Erwin Rebhandl
Allgemeinarzt in OÖ & Initiator der Syptomdatenbank für Seltene Erkrankungen
Fachkurzinformation:
Cerezyme 200 U Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Cerezyme 400 U Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Qualitative und quantitative Zusammensetzung: Jede Durchstechflasche enthält
200/400 Einheiten* Imiglucerase**. Nach dem Auflösen enthält die Lösung 40 Einheiten
(etwa 1,0 mg) Imiglucerase pro ml (200/400 Einheiten/5 bzw.10 ml).
* Eine Enzymeinheit (E) ist die Menge Enzym, die die Hydrolyse von 1 Mikromol des synthetischen Substrats para-Nitrophenyl-b-D-Glucopyranosid (pNP-GLc) in einer Minute bei 37 °C katalysiert. ** Imiglucerase ist eine modifizierte Form von humaner saurer b-Glukozerebrosidase und wird durch rekombinante DNA-Technologie mittels einer Zellkultur aus Ovarialzellen des chinesischen Hamsters (CHO) mit MannoseModifizierung für das Targeting von Makrophagen produziert.
Sonstige Bestandteile:
Eine ausführliche Liste der Hilfsstoffe findet sich in Abschnitt 6.1.
Dieses Arzneimittel enthält Natrium und wird in intravenöser 0,9%iger Natriumchloridlösung verabreicht (siehe Abschnitt 6.6).
Nach dem Auflösen enthält die Lösung 0,62/1,24 mmol Natrium (200/400 Einheiten/5 bzw.10ml). Dies ist zu berücksichtigen bei Patienten unter Natrium kontrollierter Diät.
Liste der sonstigen Bestandteile:
Mannitol, Natriumzitrat (zur Einstellung des pH-Werts), Zitronensäure-Monohydrat (zur Einstellung des pH-Werts), Polysorbat 80.
Anwendungsgebiete:
Cerezyme (Imiglucerase) ist für die langfristige Enzymsubstitutionstherapie von Patienten mit bestätigter Diagnose der nichtneuronopathischen (Typ1) oder der chronisch neuronopathischen (Typ3) GaucherKrankheit mit klinisch signifikanten nicht-neurologischen Manifestationen der Krankheit bestimmt.
Die nicht-neurologischen Manifestationen der Gaucher-Krankheit umfasseneines oder mehrere der folgenden Symptome:
Anämie nach Ausschluss anderer Ursachen, z.B.Eisenmangel; Thrombozytopenie; Knochenerkrankung nach Ausschluss anderer Ursachen, z.B.Vitamin D-Mangel; Hepatomegalie oder Splenomegalie.
Gegenanzeigen:
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe.
Zulassungsinhaber: Genzyme Europe B.V., Gooimeer 10, 1411 DD Naarden, Niederlande.
Abgabe: Rezept-und apothekenpflichtig.
Pharmakotherapeutische Gruppe:
Enzyme-Imiglucerase (rekombinante, makrophagengängige, b-Glukozerebrosidase),
ATC-Code:A16AB02.
Stand der Information:Januar2012.
Weitere Angaben zu den besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen sowie den ggf. Gewöhnungseffekten sind der veröffentlichten Fachinformation zu entnehmen.
-----------------------------------------------------------------------------------------------------
VPRIV® 400 Einheiten Pulver zur Herstellung einer Infusionslösung.
Wirkstoff: Velaglucerase alfa.
Zusammensetzung: 400 Einheiten Velaglucerase alfa pro Durchstechflasche. Nach Rekonstitution enthält 1 ml Lösung 100 Einheiten Velaglucerase alfa. Sonstige Bestandteile: Sucrose, Natriumcitrat-2 H2O (E331), Citronensäure-Monohydrat (E330), Polysorbat 20.
Anwendungsgebiete: VPRIV ist zur Langzeit-Enzymersatztherapie (EET) bei Patienten mit Gaucher-Krankheit des Typs 1 indiziert.
Dosierung und Anwendung: 60 Einheiten/kg jede zweite Woche intravenös. Dosierungsanpassungen können individuell vorgenommen werden. Anw. zu Hause unter Aufsicht medizinischer Fachkraft möglich, wenn Patient mindestens 3 Infusionen erhalten und gut vertragen hat.
Gegenanzeigen: Schwere allergische Reaktion auf Wirkstoff o. sonst. Bestandteile.
Nebenwirkungen: Sehr häufig (?1/10): Kopfschmerz, Schwindelgefühl, Knochenschmerzen, Arthralgie, Rückenschmerzen, Reaktion in Zusammenhang mit einer Infusion, Asthenie/ Ermüdung, Fieber/Körpertemperatur erhöht. Häufig (?1/100 bis <1/10): Überempfindlichkeitsreaktion, Tachykardie, Hypertonie, Hypotonie, Rötung, Abdominalschmerzen/ Schmerzen Oberbauch, Übelkeit, Ausschlag, Urtikaria, aktivierte partielle Thromboplastinzeit verlängert, Test auf neutralisierende Antikörper positiv. In klinischen Studien mit Kindern und Jugendlichen von 4 bis 17 Jahren war das Sicherheitsprofil von VPRIV das gleiche wie das bei erwachsenen Patienten beobachtete.
Warnhinweis: Enthält Natrium.
Weitere Angaben: s. Fach- und Gebrauchsinformation. Verschreibungspflichtig.
Stand der Fachinformation: Dezember 2013, Shire Pharmaceuticals Ireland Ltd., 5 Riverwalk, Citywest Business Campus, Dublin 24, Irland. Örtlicher Vertreter: Shire Deutschland GmbH, 10117 Berlin; Tel.: +49 30 206582-0; Fax: +49 30 206582-100; www.shire.de