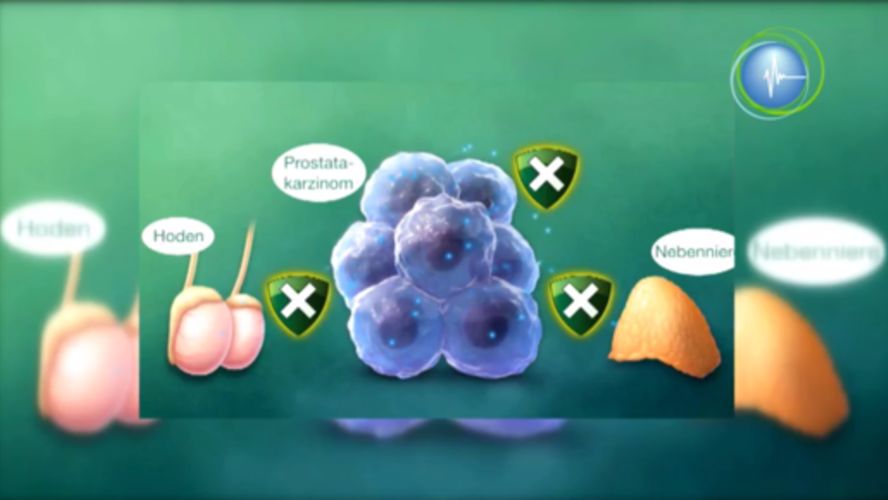
Prostatakrebs gehört zu den häufigsten Krebserkrankungen unter Männern: jährlich gibt es in Österreich ca. 8.000 neue Fälle.
Im Laufe der Erkrankung kommt es bei vielen Patienten zu einer Resistenz gegen die Primärtherapie - man spricht vom kastrationsresistenten Prostatakarzinom. In diesen Fällen kommen neue Substanzen zum Einsatz.
Fachkurzinformation
Bezeichnung des Arzneimittels: ZYTIGA 250 mg Tabletten.
Qualitative und quantitative Zusammensetzung: Jede Tablette enthält 250 mg Abirateronacetat.
Sonstige Bestandteile: Jede Tablette enthält 189 mg Lactose und 6,8 mg Natrium. Mikrokristalline Cellulose, Croscarmellose-Natrium, Lactose-Monohydrat, Magnesiumstearat, Povidon (K29/K32), Hochdisperses Siliciumdioxid, Natriumdodecylsulfat.
Anwendungsgebiete: ZYTIGA ist indiziert mit Prednison oder Prednisolon zur Behandlung des metastasierten kastrationsresistenten Prostatakarzinoms bei erwachsenen Männern mit asymptomatischem oder mild symptomatischem Verlauf der Erkrankung nach Versagen der Androgenentzugstherapie, bei denen eine Chemotherapie noch nicht klinisch indiziert ist und zur Behandlung des metastasierten kastrationsresistenten Prostatakarzinoms bei erwachsenen Männern, deren Erkrankung während oder nach einer Docetaxel-haltigen Chemotherapie progredient ist.
Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile. Frauen, die schwanger sind oder schwanger sein könnten, schwere Leberfunktionsstörung [Child-Pugh Klasse C].
Inhaber der Zulassung: Janssen-Cilag International NV, Turnhoutseweg 30, B-2340 Beerse, Belgien.
Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. ATC-Code: L02BX03.
Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit sowie Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation (108297)
FACHKURZINFORMATION Xtandi
1. Bezeichnung: Xtandi 40 mg Weichkapseln
2. Zusammensetzung (arzneilich wirksame Bestandteile nach Art und Menge): Jede Weichkapsel enthält 40 mg Enzalutamid. Sonstiger Bestandteil mit bekannter Wirkung: Jede Weichkapsel enthält 52,4 mg Sorbitol. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. Anwendungsgebiete: Xtandi ist angezeigt zur Behandlung erwachsener Männer mit metastasiertem kastrationsresistentem Prostatakarzinom, deren Erkrankung während oder nach einer Chemotherapie mit Docetaxel fortschreitet.
4. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile; Frauen, die schwanger sind oder schwanger werden können (siehe Abschnitt 4.6 der Fachinformation)
5. Pharmakologische
Eigenschaften: Pharmakotherapeutische Gruppe: noch nicht zugewiesen, ATC-Code: noch nicht zugewiesen
6. Pharmazeutische Angaben (Hilfsstoffe): 6.1 Liste der sonstigen Bestandteile: Kapselinhalt: Macrogolglycerolcaprylocaprate 400, Butylhydroxyanisol (E 320), Butylhydroxytoluol (E 321); Kapselhülle: Gelatine, Lösung von partiell dehydratisiertem Sorbitol (Sorbitol, Sorbitan), Glycerol, Titandioxid (E 171), gereinigtes Wasser; Drucktinte: Eisen(II,III)-oxid (E 172), Poly(phthalsäure-covinylacetat)
7. Pharmazeutischer Unternehmer: Astellas Pharma Europe B.V., Sylviusweg 62, 2333 BE Leiden, Niederlande
8. Verschreibungspflicht/ Apothekenpflicht:
rezept- und apothekenpflichtig
Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation.“